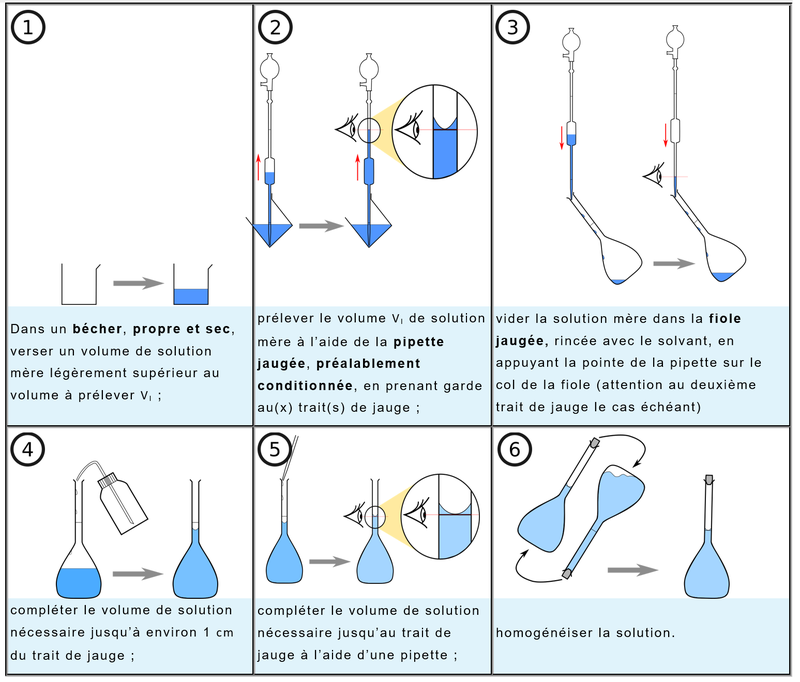
Préparer une solution par dilution
En chimie, nous sommes souvent amenés à préparer des solutions par dilution d’une solution mère plus concentrée.
Rappel : la dilution consiste à ajouter du solvant (souvent de l’eau distillée) à une solution initiale afin de diminuer sa concentration. La quantité de soluté reste inchangée, seul le volume de solution augmente
Pour commencer il nous faut déterminer le facteur de dilution F (« de combien de fois va-t-on diluer la solution mère »). On sait que :
$$\gamma = \frac{m_\text{soluté}}{V_\text{solution}}$$
donc :
$$m_{mère} = \gamma_{mère} \cdot V_{mère} \text{ et }m_{fille}= \gamma_{fille} \cdot V_{fille}$$
La masse m de soluté prélevée dans la solution mère reste la même lors d’une dilution ainsi :
$m = m_{mère}=m_{fille}$
$$m = \gamma_{mère} \cdot V_{mère} = \gamma_{fille} \cdot V_{fille}$$
$$\quad\Rightarrow\quad \frac{\gamma_{mère}}{\gamma_{fille}} = \frac{V_{fille}}{V_{mère}} = F$$
On dispose d’une solution mère de sulfate de cuivre(II) de concentration massique $\gamma_{mère} = 80 \text{ g·L}^{-1}$
On souhaite préparer 100 mL d’une solution fille de concentration massique $\gamma_{fille} = 20 \text{ g·L}^{-1}$
Pour commencer, il nous faut déterminer le facteur de dilution F
On sait que :
$$F = \frac{\gamma_{mère}}{\gamma_{fille}} = \frac{80}{20} = 4$$
Pour déterminer le volume $V_{mère}$ de solution mère à prélever. Il faut donc prélever un volume donné par la relation :
$$F = \frac{V_{fille}}{V_{mère}}\Rightarrow\quad V_{mère} = \frac{V_{fille}}{F}$$
On utilisera donc :
- une pipette jaugée de volume $V_{mère}$
- une fiole jaugée de volume $V_{fille}$
Déterminons maintenant le volume mère à prélever :
$$F = \frac{V_{fille}}{V_{mère}}$$
$$\Rightarrow V_{mère} = \frac{V_{fille}}{F} = \frac{100}{4}= 25 \text{ mL}$$
On utilisera donc une fiole jaugée de 100 mL et une pipette jaugée de 25 mL